澳門大學中華醫藥研究院副教授王瑞兵的研究團隊基於巨噬細胞卓越的炎症趨向性,開發了以巨噬細胞作為載體的超分子藥物遞送平台,並催化產生氧氣作為推動力。團隊利用平台裝載能夠抑制炎症的中藥小分子薑黃素,對急性肺炎有良好的治療效果。研究成果已發表在知名頂級學術期刊《先進材料》(Advanced Materials)。
薑黃素作為被廣泛研究的中藥小分子,在很多炎性疾病中顯示出具良好的治療潛力,但薑黃素本身並無炎性組織靶向富集作用,即薑黃素單獨使用時,不能精準地聚集在炎症組織中,因此臨床效果不盡如人意。近年,活細胞作為藥物載體受到越來越多關注,因為活細胞具有高度生物相容性,較低機會引起不良反應。活細胞也有長循環的特性,作為載體,能延長藥物在人體內停留的時間。而且活細胞能將藥物針對性地運輸到某一特定組織中,從而提高藥物在該組織中的濃度和療效,具有很強的富集作用。然而,活細胞遞送小分子藥物如薑黃素,卻容易造成薑黃素分子胞內代謝,或在遞送過程中外排損失。
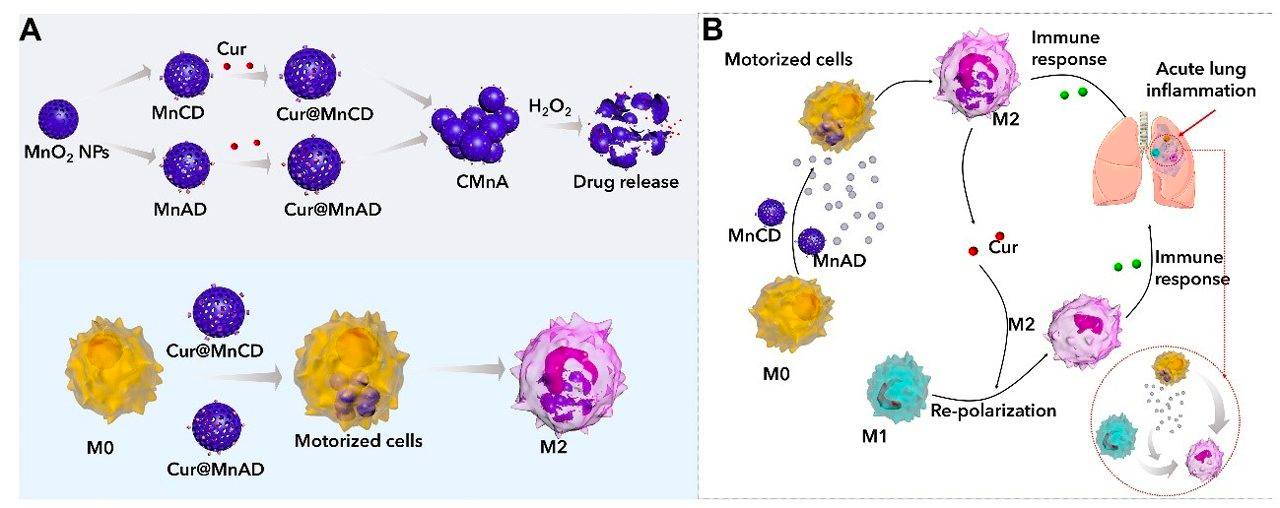
研究團隊將薑黃素裝載於由主客體分子分別修飾的二氧化錳納米粒中,並利用細胞內超分子自組裝技術,將載藥二氧化錳納米粒鎖定在巨噬細胞中,抑制納米藥物提前洩露。載藥巨噬細胞通過對炎性組織的趨向性,富集在急性肺炎組織。由於炎症部位的高氧化微環境,納米粒催化過氧化氫產生氧氣,推動巨噬細胞馬達(也可稱之為 巨噬細胞機器人)快速浸潤組織,同時薑黃素得以在炎性組織釋放,極化巨噬細胞,協同調節炎症微環境,抑制並逆轉炎症發展。
此前,研究團隊基於超分子自組裝技術開發了一系列基於活細胞的藥物遞送平台,相關研究成果發表在《自然通訊》(Nature Communications)《科學進展》(Science Advances)《今日材料》(Materials Today)《先進功能材料》(Advanced Functional Materials)等期刊上。團隊創立的超分子細胞工程化技術,利用主客體分子的強作用力,將納米藥物鎖定在細胞中,或鉚釘在細胞外表面,利用活細胞實現藥物的靶向富集和精準釋放,有效針對性地調控與治療炎性疾病,相關成果獲得2022年澳門特別行政區科學技術獎—自然科學二等獎。
是次研究課題在前期工作的基礎上,進一步設計可自主推動的細胞機器人,可快速浸潤炎性組織,有利於快速干預急性炎症發展。該研究成果以“炎症趨向性自推動巨噬細胞馬達用於急性肺炎的治療”(Chemotaxis-guided self-propelled macrophage motor for targeted treatment of acute pneumonia)為題,發表於知名學術期刊《先進材料》(Advanced Materials)。該論文唯一通訊作者為王瑞兵,博士生岳魯丹為第一作者;中華醫藥研究院特聘教授李銘源,研究助理教授高成,博士生李俊燕、陳漢斌、羅銳鋒等對此研究作出重要貢獻。此項研究由澳門特別行政區科學技術發展基金(檔案編號:0086/2022/A2和0065/2021/A2)、國家自然科學基金(檔案編號:22271323和22071275)和深圳市科技創新委員會(檔案編號:EF023/ICMS-WRB/2022/SZSTIC)資助。